恒瑞医药拟再度踏上“加速审批”快车道 剑指千亿非小细胞肺癌市场
10月23日,恒瑞医药发布公告称药品卡瑞利珠单抗联合法米替尼一线治疗复发性或转移性非小细胞肺癌被国家药品监督管理局药品审评中心拟纳入突破性治疗品种公示名单。
突破性治疗一词起源于美国,2012年7月美国FDA突破性疗法认证(breakthrough therapy designation,BTD)在国会获得通过,成为继快速通道、优先审评、加速批准之后美国FDA新药快速审批的又一个特殊通道,旨在缩短那些“严重或危及生命的疾病”新药的开发和审评时间。
随后,我国国家药品监督管理局于2020年7月8日组织制定《突破性治疗药物审评工作程序(试行)》等三个文件,中国版“突破性疗法”通道正式开启,明确将用于防治严重危及生命、严重影响生存质量且尚无有效防治手段,以及与现有治疗手段相比具有明显临床优势的创新药、改良型新药等,纳入突破性治疗品种名单。
CDE对纳入突破性治疗药物审评程序的品种会采取一系列支持政策,加强指导并促进药物研发进程,优先处理相关沟通交流,从而加快药物研发进程,加速其在国内的上市进程,更早解决中国病患未满足的临床需求。目前我国突破性治疗药物审评时限为130日,相比普通上市审批周期大幅缩短。
本次恒瑞医药拟入选疗法为卡瑞利珠单抗联合法米替尼一线治疗复发性或转移性非小细胞肺癌。卡瑞利珠单抗是恒瑞医药自主研发并具有知识产权的人源化PD-1单克隆抗体。而苹果酸法米替尼则是恒瑞医药自主研发的全新小分子多靶点酪氨酸激酶抑制剂,属分子靶向性抗肿瘤药物。
据头豹研究院报告显示,近5年来,中国非小细胞肺癌药物行业市场规模呈现快速增长的趋势。根据服务端患者用药情况统计,2015-2019年,中国非小细胞肺癌药物行业市场规模由187.3亿元增长至424.6亿元,年复合增长率为22.7%。到2024年,市场规模有望上升至822.4亿元。
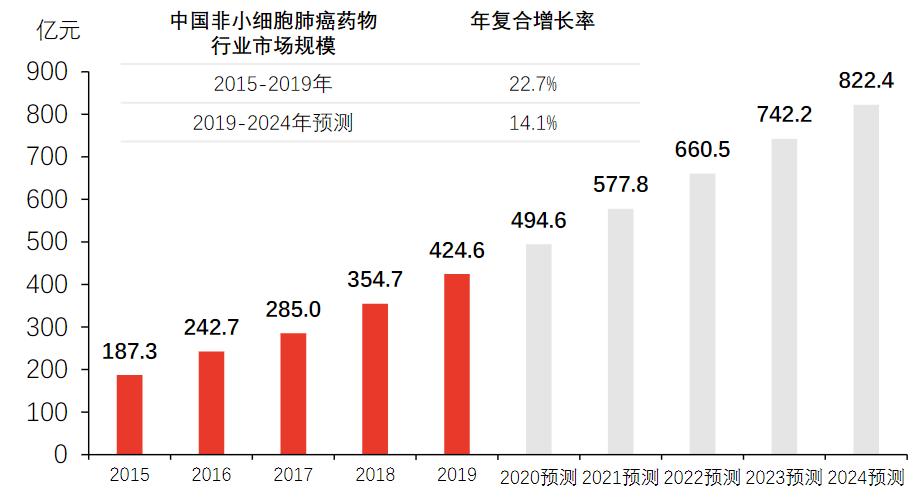
资料来源:头豹研究院编辑整理
因此,卡瑞利珠单抗联合法米替尼一线治疗复发性或转移性非小细胞肺癌如能成功进入突破性治疗名单并上市,或将成为恒瑞医药业绩增长的一大助力。
目前,恒瑞医药正在开发二者联合治疗宫颈癌、肺癌、肾细胞癌等多种实体瘤。据恒瑞医药2022年半年报显示,苹果酸法米替尼联合卡瑞利珠单抗治疗宫颈癌此前已被CDE纳入突破性治疗名单。
交易商排行
更多- 监管中EXNESS10-15年 | 英国监管 | 塞浦路斯监管 | 南非监管92.42
- 监管中FXTM 富拓10-15年 |塞浦路斯监管 | 英国监管 | 毛里求斯监管88.26
- 监管中GoldenGroup高地集团澳大利亚| 5-10年85.87
- 监管中金点国际集团 GD International Group澳大利亚| 1-2年86.64
- 监管中Moneta Markets亿汇澳大利亚| 2-5年| 零售外汇牌照80.52
- 监管中IC Markets10-15年 | 澳大利亚监管 | 塞浦路斯监管91.81
- 监管中CPT Markets Limited5-10年 | 英国监管 | 伯利兹监管91.56
- 监管中GO Markets高汇15-20年 | 澳大利亚监管 | 塞浦路斯监管 | 塞舌尔监管87.90
- 监管中alpari艾福瑞5-10年 | 白俄罗斯监管 | 零售外汇牌照87.05
- 监管中易信easyMarkets15-20年 |澳大利亚监管 | 塞浦路斯监管86.33


