创新药企恒润达生IPO:实控人轻工机械专业出身、曾任职险企,尚无产品上市,三年半累亏超5亿元
10月18日,上交所官网显示,上海恒润达生生物科技股份有限公司(简称“恒润达生”)科创板上市申请获受理。
恒润达生拟募资25.39亿元,用于肿瘤免疫细胞治疗产品研发项目、总部及产业化基地(一期)项目以及补充流动资金。
值得一提的是,2020年以来,生物医药行业上市企业经历过持续升温股价起飞的阶段,也体验过股价震荡下行、估值不断创新低的窘境。多家2020年后上市的创新药企也曾陷入“上市即巅峰”的怪圈。
以君实生物为例,该公司2020年7月15日登陆科创板,上市首日股价涨幅达172.7%,首日盘中还创下上市以来最高价220.4元/股。不过,截至2022年10月19日收盘,君实生物报53.38元/股,股价已低于发行价。
此次闯关科创板的恒润达生,尚无产品上市销售且处于持续亏损状态,该公司不仅需解决盈利问题,若成功登陆A股还将面临投资者的审视。
实控人险企职员出身,三年半亏损5.28亿元
成立于2015年的恒润达生是一家专注于突破性免疫细胞治疗产品研发及生产的创新生物医药公司,主要聚焦恶性血液病和实体肿瘤等治疗领域。
恒润达生虽为创新药公司,但其创始人及实控人李国顺却并非医药科班出身,算得上是跨界创业。
2015年,李国顺、上海寓庸、李国清、上海觉海和恒润研究院共同出资设立恒润达生前身达生有限。恒润达生经过多轮增资及股权转让,引进了深创投、杭州红土、安捷医疗等投资者。目前,李国顺通过直接、间接持股和一致行动人关系合计控制49.1798%股份,为公司实控人。
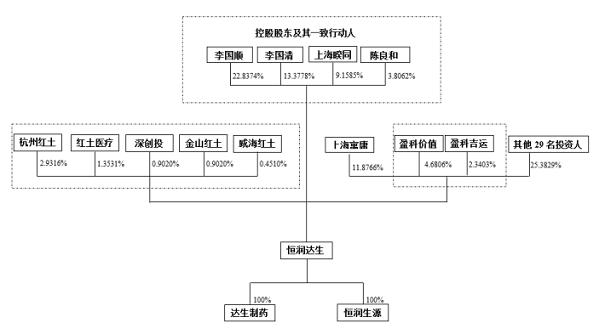
据招股书,李国顺1987年毕业于福建省莆田市技术学院轻工机械专业,中等专科学历。1991年至1997年间,其曾为中国人民保险公司莆田分公司职员。1998年,李国顺摇身一变成为上海秀屿医疗器械技术有限公司副总经理,正式进入医药领域。
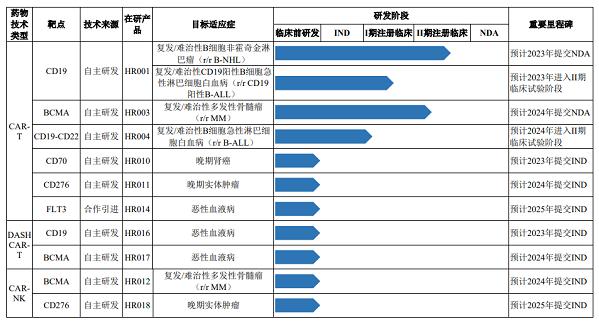
成立7年的恒润达生目前已建立包含10个产品的11个研发管线,涉及2种细胞类型产品体系。其中,2项在研项目已处于Ⅱ期注册临床试验阶段,2项处于Ⅰ期注册临床试验阶段,多项应用了CAR-NK、DASH CAR-T等技术开发的在研管线处于临床前研究阶段。
所有产品均处于在研阶段也意味着恒润达生尚无产品销售收入,而由于不断的研发投入以及股权激励,该公司持续亏损。
2019-2021年及2022年上半年,恒润达生归属于股东的净亏损分别为1.17亿元、1.03亿元、1.93亿元和1.17亿元,三年半合计亏损达5.28亿元。截至2022年6月30日,该公司累计未分配利润为-2.76亿元。
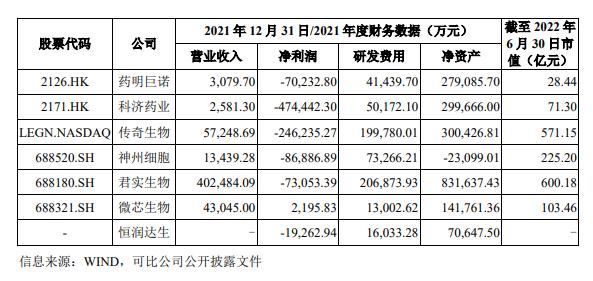
恒润达生2019-2021年及2022年1-6月的研发费用分别为8436.79万元、8459.53万元、1.6亿元、9964.31万元,逐年增长,但与同行业可比上市公司相比,该公司研发投入仍处于较低水平。
公开资料显示,2021年,君实生物、科济药业、药明巨诺的研发费用分别为20.69亿元、5.02亿元、4.14亿元,分别为恒润达生的12.9倍、3.13倍、2.58倍。
此外,为激励员工为公司长期发展服务,2019-2021年及2022年上半年,恒润达生均进行了股权激励,股权激励费用分别为1316.07万元、694.4万元、1786.17万元、661.43万元。
恒润达生表示,公司未来几年将存在持续大规模的研发投入,在可预见的未来经营亏损将不断增加,上市后未盈利状态预计持续存在且累计未弥补亏损可能继续扩大。
产品最早2023年提交上市申请,已有同类药物获批上市
正处于Ⅱ期注册临床试验阶段的HR001、HR003产品,作为恒润达生研发进展最快的在研产品被寄予厚望。
招股书显示,恒润达生在研产品HR001用于治疗复发/难治性B细胞非霍奇金淋巴瘤(r/r B-NHL)适应症,预计于2023年提交新药上市申请(NDA);HR003用于治疗复发/难治性多发性骨髓瘤(r/r MM)适应症,预计2024年提交NDA。
公开资料显示,未来CAR-T细胞治疗NHL中国市场规模有望快速增长,预计2021年至2025年复合增长率为149.6%,预计2025年至2030年复合年增长率为41%,并在2030年增长至184亿元。
截至2022年6月30日,中国尚无治疗MM的CAR-T细胞治疗产品获批上市。预计中国CAR-T细胞治疗MM市场规模将在2030年增长至71亿元,2025年至2030年的复合增长率预计为43%。
值得注意的是,国内已经针对r/r B-NHL适应症的同类药物获批上市销售,已有针对r/r MM的同类药物提交NDA,且有多个同类药物处于不同的临床试验阶段。恒润达生HR001、HR003未来获批上市销售后,不仅面临上述品种的直接竞争,还将与同适应症的其他药品展开竞争。
2021年9月,药明巨诺CAR-T细胞治疗产品瑞基奥仑赛注射液(商品名:倍诺达)获国家药品监督管理局(NMPA)批准上市,适应症为用于经过二线或以上系统性治疗后成人患者的复发或难治性大B细胞淋巴瘤(r/r LBCL);2022年9月30日,倍诺达治疗复发或难治性滤泡淋巴瘤患者适应症获NMPA批准。
针对r/r MM适应症,科济药业用于治疗r/r MM的产品全人抗BCMA CAR-T(CT053)已完成了中国关键Ⅱ期患者入组,并正在北美进行关键Ⅱ期试验。
2022年2月底,传奇生物/杨森制药联合开发的抗BCMA CAR-T细胞治疗产品,被美国食品药品监督管理局(FDA)批准上市,用于治疗r/r MM成人患者。
值得一提的是,恒润达生尚无商业化销售产品的经验,尚未组建完整的商业化团队。现阶段公司规模较小,存在销售团队招募进度不及预期及入职后短期内流失的风险。
在研产品临床进展及审批进度是否及预期,产品上市后是否具有竞争力,均存在一定不确定性,恒润达生若想在激烈的竞争中突出重围还需做出更多努力。
交易商排行
更多- 监管中EXNESS10-15年 | 英国监管 | 塞浦路斯监管 | 南非监管93.02
- 监管中FXTM 富拓10-15年 |塞浦路斯监管 | 英国监管 | 毛里求斯监管88.21
- 监管中FXBTG10-15年 | 澳大利亚监管 |83.48
- 监管中GoldenGroup高地集团澳大利亚| 5-10年85.87
- 监管中IC Markets10-15年 | 澳大利亚监管 | 塞浦路斯监管91.71
- 监管中CPT Markets Limited5-10年 | 英国监管 | 伯利兹监管91.56
- 监管中AUS Global5-10年 | 塞浦路斯监管 | 澳大利亚监管86.47
- 监管中OneRoyal10-15年 | 澳大利亚监管 | 塞浦路斯监管 | 瓦努阿图监管85.75
- 监管中易信easyMarkets15-20年 |澳大利亚监管 | 塞浦路斯监管85.38
- 监管中FXCC10-15年 | 塞浦路斯监管 | 直通牌照(STP)85.26


