创新药大事件:国产创新药又一王牌种子选手!有望成为全球同类最优的舒沃替尼申请上市
近日,迪哲医药发布公告称收到国家药品监督管理局核准签发的《受理通知书》,舒沃替尼片用于既往接受过铂类化疗、携带表皮生长因子受体20号外显子插入(以下简称“EGFR 20”)突变的局部晚期或转移性非小细胞肺癌(NSCLC)的成人患者的新药上市申请(NDA)获得受理。
这也意味着,如果一切顺利的话,舒沃替尼有望在明年完成审评事项并获得药品上市许可,为晚期非小细胞肺癌(NSCLC)携带EGFR 20突变的患者带来曙光。对于不了解这一疾病的人而言,或许并不能理解舒沃替尼在非小细胞肺癌治疗领域的重要意义,那么不妨来看一组数据。
2020年患者数量约2.46万人
资料显示,非小细胞肺癌约占所有肺癌的80%,约75%的患者发现时已处于中晚期,5年生存率很低。而表皮生长因子受体(EGFR)突变是非小细胞肺癌(NSCLC)患者最常见的突变基因之一,亚洲携带EGFR基因突变患者占NSCLC患者的40%至60%,其中,EGFR 20突变相对罕见,发生率约占EGFR基因突变的4%至10%。
也就是说,每100个肺癌患者中,就有约3个患者发生EGFR 20突变,结合我国庞大的肺癌患者人群来看,对应患者人数将是一个庞大的数字。2022年国家癌症中心发布最新一期的全国癌症统计数据显示,2020年中国肺癌新发病例数及病例死亡数均位居榜首,仅2020年一年国内便有82万新发肺癌病例,按比例估算携带EGFR 20的NSCLC患者人数约24600人。
目前,铂类药物化疗是肺癌的主要治疗方法,但是该方法对患者自身身体情况有一定要求,且副作用明显,因此,越来越多的人选择靶向药物,如EGFR酪氨酸激酶抑制剂(EGFR-TKI)进行治疗。
然而不幸的是,EGFR 20作为插入突变,由于插入位点和插入片段的不同,突变亚型繁多、异质性高,至今已发现约122种亚型,不同亚型对同一种药物的敏感性不完全一样。因此,想要研发出一款针对多种EGFR 20突变亚型都安全有效的药物是非常困难的。
资料显示,传统EGFR-TKI、免疫治疗与化疗用于EGFR 20突变型晚期NSCLC的客观缓释率不足20%。有研究表明23%至39%的EGFR 20突变型晚期NSCLC患者治疗初期即存在脑转移,未经治疗的肺癌脑转移患者中位生存期仅为1-2个月。 因此,针对EGFR 20突变型晚期NSCLC患者亟需更加高效且安全的靶向新药。
舒沃替尼:有望成为针对 EGFR 20突变“Best-in-class”治疗药物
说到这里就不得不提到今天的主角——舒沃替尼。舒沃替尼是迪哲医药自主研发的高选择性表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI),对包括20号外显子插入突变在内的多种EGFR和HER2突变都有较强活性。
舒沃替尼的NDA申请是基于一项舒沃替尼用于治疗既往接受过铂类化疗、EGFR20突变晚期非小细胞肺癌(NSCLC)患者的中国注册临床试验“悟空6(WU-KONG6)”的结果。临床结果显示,截至2022年7月31日,舒沃替尼治疗既往接受含铂化疗失败的EGFR20突变型晚期NSCLC,在II期推荐剂量300mg下,总体缓释率高达59.8%。
这一缓释率有多高呢?可以与海外市场中的同类竞品进行一个比对。武田附条件上市的Mobocertinib(TAK-788)客观缓解率为28%、强生附条件上市的Amivantamab(JNJ-61186372)客观缓解率为40%、Cullinan Oncology在研管线CLN-081观缓解率为38%。由此可见迪哲医药自主研发的舒沃替尼是有多么“能打”。
同时,研究提示,“悟空6(WU-KONG6)”试验中,31例基线伴有脑转移的患者占比达32%,而舒沃替尼对其治疗后经确认的客观缓解率高达48.4%,比同类产品更优。此外,本次研究共纳入30种EGFR 20突变亚型,不论插入突变发生位置,舒沃替尼治疗后均可观察到抗肿瘤活性。
安全性方面,舒沃替尼同样强势。来自国内外四项多中心临床研究包括WU-KONG1、WU-KONG2、WU-KONG6、WU-KONG15的数据汇总分析结果显示,舒沃替尼整体安全性良好,常见不良反应类型与传统EGFR-TKI类似,且绝大多数为1-2级不良反应,临床可管理及恢复。
值得一提的是,凭借着卓越的疗效与安全性,舒沃替尼也成为肺癌领域首个也是目前唯一获得中、美双“突破性疗法认定”的国创新药。同时,舒沃替尼研究成果也在多个国际学术会议(2019AACR、2021ASCO、2021WCLC)上发表。
市场前景可期,国药出海种子选手
从市场角度来看,已上市小分子EGFR抑制剂(共三代产品)对EGFR 20患者几乎无效,特异性针对EGFR 20的靶向药物较少,且疗效一般,国内外市场中缺少能与舒沃替尼抗衡的同类竞品,市场竞争格局良好。
截至2022年11月30日,全球已获批针对EGFR/HER2 Exon 20ins的药物仅强生的Amivantamab及武田的Mobocertinib(21年有条件批准),另有Poziotinib申报NDA,舒沃替尼处于全球注册2期临床,位列第四。国内市场尚无针对EGFR Exon 20ins的靶向药获批,仅武田的Mobocertinib申报NDA。
因此,舒沃替尼有望凭借其“Best-in-class”的临床疗效,在竞争尚不激烈的EGFR 20市场中占据优势地位。据华泰证券测算,舒沃替尼有望在2023年、2024年分别于中美获批,并有望于中国、海外分别实现25.1亿元、77.7亿元的销售峰值,且未来有望向EGFR突变一线治疗及其他exon20突变的实体瘤开拓。
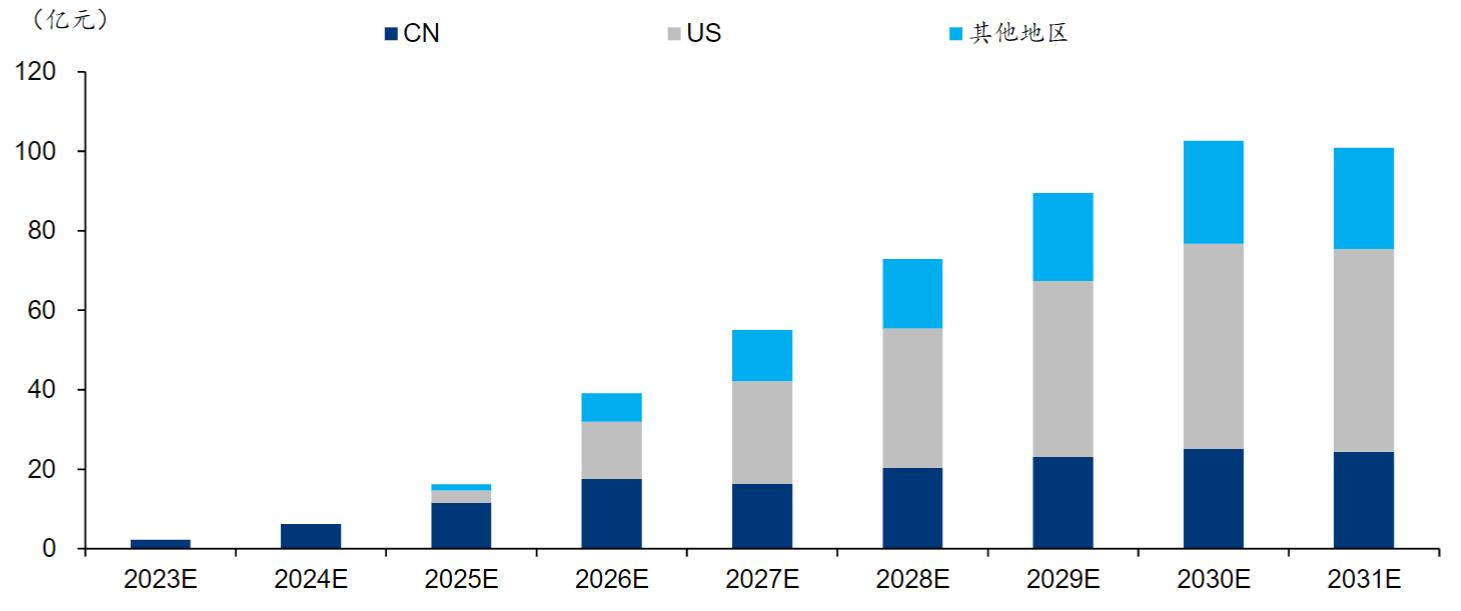
资料来源:Frost & Sullivan,医药魔方,PDB,Evaluate Pharma,华泰证券
此外,由于舒沃替尼有望具备“Best-in-class”的市场地位,因而其通过对外授权实现产品出海的预期也比较强烈,尤其是在近年来国产新药license out频现的背景之下。汇总国产单一创新药对外授权金额情况可以发现,具备“Best-in-class”潜力的品种金额较为客观,通常在20亿美元左右。
例如百济神州以总金额22亿美元、28亿美元分别向诺华授权替雷利珠单抗、ociperlimab,荣昌生物以总金额26亿美元向西雅图基因授权维迪西妥单抗等等。而舒沃替尼作为细分赛道的王牌品种,未来出海的金额同样值得期待。华泰证券预计,舒沃替尼首付款及里程碑付款的总和有望达15亿美元左右。
更多创新药大事件,请关注金融界医药生物工作室。

交易商排行
更多- 监管中EXNESS10-15年 | 英国监管 | 塞浦路斯监管 | 南非监管93.02
- 监管中FXTM 富拓10-15年 |塞浦路斯监管 | 英国监管 | 毛里求斯监管88.21
- 监管中FXBTG10-15年 | 澳大利亚监管 |83.48
- 监管中GoldenGroup高地集团澳大利亚| 5-10年85.87
- 监管中IC Markets10-15年 | 澳大利亚监管 | 塞浦路斯监管91.71
- 监管中CPT Markets Limited5-10年 | 英国监管 | 伯利兹监管91.56
- 监管中AUS Global5-10年 | 塞浦路斯监管 | 澳大利亚监管86.47
- 监管中OneRoyal10-15年 | 澳大利亚监管 | 塞浦路斯监管 | 瓦努阿图监管85.75
- 监管中易信easyMarkets15-20年 |澳大利亚监管 | 塞浦路斯监管85.38
- 监管中FXCC10-15年 | 塞浦路斯监管 | 直通牌照(STP)85.26


