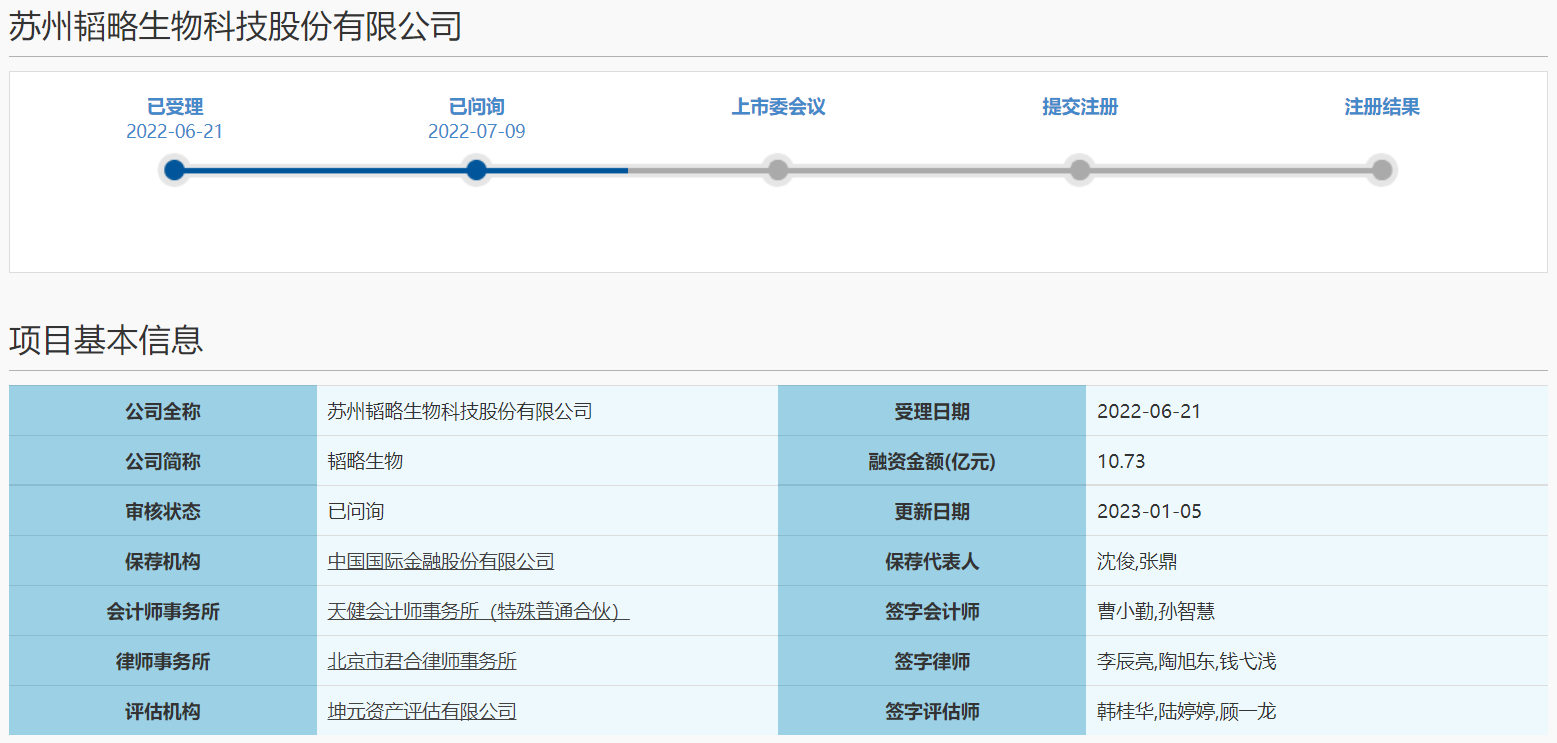
韬略生物答复科创板二轮问询,在研管线、市场空间大等被关注
2023年1月6日,苏州韬略生物科技股份有限公司(下称“韬略生物”)回复科创板二轮问询。
图片来源:上交所官网
在二轮问询中,上交所主要关注韬略生物在研管线、市场空间大、研发管线与伴随诊断产品等五个问题。
关于市场空间大,根据招股说明书及首轮问询回复,发行人针对主要管线进行了市场空间测算,其中苏特替尼适应症2和适应症3目标患者合计人群在2021年约为3,100人;相关市场渗透率及治疗费用主要参考了奥希替尼及阿法替尼等。
上交所要求发行人说明:(1)公司主要管线目标患者人群数量、市场渗透率、治疗费用等数据的来源及依据,相关依据是否权威、客观;(2)结合前述情况进一步完善公司主要管线的市场空间测算,是否满足“市场空间大”的上市条件。
韬略生物回复称,除了进展相关较快的主要产品及其适应症外,发行人还在持续拓展主要产品新的适应症,如TL118已于2022年第三季度向CDE提交用于治疗儿童实体瘤患者的临床试验申请,发行人也正在评估TL118用于镇痛领域的临床应用潜力;克耐替尼也正在开展用于治疗复发或难治性B细胞淋巴瘤的Ib期临床试验。此外,发行人还有丰富的其他在研管线,如TL938、TL117、TL139等多个有潜力的产品正在开展I期临床试验。综上,随着上述在研管线的持续推进,有望进一步拓展公司产品适应症领域和市场规模。
综上所述,苏特替尼、TL118和克耐替尼在中国和美国具有较大的市场规模,且当前缺乏有效的治疗药物,与已获批或在研竞品相比有差异化竞争优势,同类竞争产品较少,临床试验结果亦初步展现安全性和有效性优势,满足“市场空间大”的要求。
关于苏中药业,根据招股说明书及首轮问询回复,发行人全资子公司江苏迈度将其申请苏特替尼专利的国内独占使用权转让给苏中药业,公司享有苏特替尼化合物专利所有权、苏中药业享有苏特替尼化合物专利在国内的独占使用权,苏中药业曾为发行人的大股东。
上交所要求发行人说明:(1)授予苏中药业相关专利独占使用权的使用期限、到期后的续期安排、是否约定可能导致终止授权的具体条款;(2)结合发行人相关专利及核心技术先进性、授权专利独占使用费用的公允性、相关专利由苏中药业独占使用期限内苏特替尼对应中美市场的商业规模及量化盈利预计、苏中药业入股发行人的价格公允性说明发行人让渡主要产品国内市场权益的合理性,是否与苏中药业存在其他利益安排,是否因苏中药业与发行人长期合作并授权取得相关产品国内市场权益而存在潜在专利纠纷的风险,并视情况作风险提示。
韬略生物回复称,根据江苏迈度与苏中药业于2010年1月签署的《技术开发(合作)合同书》的相关规定:(1)苏中药业享有苏特替尼化合物专利在国内的独占使用权;(2)《技术开发(合作)合同书》自双方签署后生效,至苏特替尼化合物专利的中国专利期满日失效。根据发行人持有的苏特替尼化合物的中国专利证书(专利名称为“作为激酶抑制剂的取代杂环化合物及其使用方法”,专利号为ZL201080027836.0),该专利为一项发明专利,专利申请日为2010年6月24日。根据《中华人民共和国专利法》第四十二条的规定,发明专利权的期限为二十年,自申请日起计算。因此,苏特替尼化合物的中国专利的到期日为2030年6月24日,江苏迈度根据《技术开发(合作)合同书》的约定授予苏中药业的苏特替尼化合物专利的国内独占使用权的使用期限截止日为2030年6月24日。综上,关于授予苏中药业苏特替尼化合物的中国专利独占使用权到期后的续期问题,公司与苏中药业无后续安排。
截至本问询回复出具之日,双方按照《技术开发(合作)合同书》的规定履行了各自的权利义务,不存在触发上述条款从而导致终止授权的情形。根据苏中药业分别于2022年1月17日、2022年2月18日出具相关说明,苏特替尼项目的产品推进状态符合双方合作预期,双方按照现有合同的约定推进各项工作,未发现任何一方有违约行为,未发生因履行合同产生争议和诉讼的情形,未发生基于现有合同向另一方及其关联方于任何时间以任何形式追究任何责任或提出任何赔偿诉求的情形。
2010年1月,发行人子公司江苏迈度仍处于创立早期,资金实力较为有限,在完成化合物分子设计并在美国申请化合物专利的基础上,发行人希望最大限度发挥化合物分子的潜在价值,故在市场上寻求合作方进行对外授权及合作研发。苏特替尼化合物具备一定技术先进性,苏中药业认为苏特替尼在中国具有较高的开发潜力,对其业务发展具有较高的战略意义,遂决定与江苏迈度就苏特替尼在中国市场进行合作。对外授权的合作研发模式属于医药行业的常见模式,早期对外授权具备商业合理性。
2010年前后,中国创新药市场尚未成熟,医药行业整体仍处于仿制阶段。江苏迈度与苏中药业开始合作时,苏特替尼处于临床前研究早期的化合物分子结构设计阶段,化合物暂未合成,化合物分子结构式价值较难评估,且受让的专利国内独占使用权彼时亦无广泛适用的针对早期项目的估值方式,因此双方结合对产品研发预期、彼时的市场环境和商业谈判综合确定授权专利使用费。此外,早期化合物或分子结构式对外授权公开披露案例较少。
中美华东曾于2015年12月以5,000万元受让华东医药集团新药研究院迈华替尼的新药技术所有权及相关专利综合比对迈华替尼及苏特替尼交易时间、交易时点的药物所处阶段、授权权益及地区等差异,判断苏特替尼的早期授权专利使用费价格公允。
为充分发挥药物价值,加速产品上市,发行人牵头主导并深度参与后续研发活动,通过对国外非经典突变创新药研发态势的追踪分析,敏锐捕捉到苏特替尼在EGFR非经典突变海内外的开发机会,确定苏特替尼以中美双报的形式在两国申请上市。同时,基于长期保持的良好合作关系,双方进一步明确了后续市场权益划分和收益分成。合作研发模式中,双方按各自负责并享有权益市场的销售额的一定比例向对方支付产品销售分成符合行业惯例,与苏中药业的权益分配具备合理性。
苏特替尼预计于2024年在中美两地获批上市并开始商业化。根据市场规模测算及盈利预测,中性情形下,针对适应症1,中国市场上市首年收入规模约为2.9亿元人民币,预计到2030年增长至5.6亿元人民币,美国市场上市首年收入规模约为1.6亿人民币,预计到2030年增长至8.1亿人民币。针对适应症2和适应症3,美国市场上市首年收入规模约为1.8亿人民币,预计到2030年增长至10.9亿人民币。在相关专利的独占使用期限内,苏特替尼对应中美市场的商业规模及盈利预测主要基于当前时点的市场空间、竞争格局及苏特替尼已获批的适应症等情况,上述情况与2010年发行人授权专利时点的整体情况及价格可比性较低。由于在专利独占使用期限内,苏特替尼国内研发费用均由苏中药业承担,因此苏特替尼国内市场主要权益由苏中药业取得具备商业合理性。
在独占使用期限内发行人虽然让渡了苏特替尼的国内市场主要权益,但根据市场规模预测,发行人仍然能通过美国市场开拓获取可观的收入,不存在让渡国内权益导致公司权益受损的影响。
江苏迈度由MEDOLUTION、苏中药业等于2009年12月设立。江苏迈度设立时注册资本为3,000万元,其中苏中药业持有江苏迈度250万元注册资本、持股比例为8.33%。
苏中药业因看好江苏迈度业务前景决定参与出资设立江苏迈度,苏中药业入股江苏迈度的价格为1元/每1元江苏迈度注册资本,定价依据为相关方协商确定的原始投资成本,具备合理性。
2016年8月,韬略有限、实际控制人DAWEIZHANG及XIAOYANGXIA、韬略有限彼时股东(包括苏州方略、苏州镛博、蒋群一、孙博、雷元芳、欧阳强)与A轮投资人(包括深创投、山东红土、昆山红土、烟台建信、上海檀贝歌)签署了《投资合同书》(以下简称“A轮投资协议”)。根据A轮投资协议的相关约定,为了消除同业竞争、满足上市需要,同时理顺境内外股权控制关系,实际控制人控制的各企业应当在A轮投资前完成境内外股权重组(以下简称“股权重组”),股权重组中包括江苏迈度的股东分别以其持有的江苏迈度的股权对韬略有限进行增资,入股价格为1元/每1元韬略有限注册资本。
苏中药业的入股与其与江苏迈度之间始于2010年的合作研发事项为互为独立的商业交易,两者不存在直接关联。此外,根据包括A轮投资协议在内的公司历次融资文件及《技术开发(合作)合同书》《技术开发(合作)补充合同书》,该等书面协议均未约定苏中药业及江苏康思尔投资入股韬略有限的相关交易与苏中药业和江苏迈度间的合作研发事项间存在任何互为条件、前提、承诺、关联或其他特殊安排的情形。
对于发行人而言,早期新药研发须投入高额资金,且结果存在较大不确定性。研发过程中,苏中药业提供充分的资金支持及人力协助,助力完成苏特替尼的化合物合成和临床前开发,对彼时尚处于早期发展阶段的发行人具备较高意义。秉承商业契约精神,双方保持合作,合力完成苏特替尼临床开发工作,同时国内相关研发费用由苏中药业承担,加速推进后续中美两地上市申请。基于前述合作研发的安排以及双方自始至今建立的信任和良好合作关系,发行人向苏中药业让渡苏特替尼国内市场权益具备合理性,且不存在其他利益安排。
根据苏特替尼化合物专利(即―作为激酶抑制剂的取代杂环化合物及其使用方法‖(专利号:ZL201080027836.0)及―Substitutedheterocycliccompoundsaskinasesinhibitorsandmethodsofusethereof‖(专利号:US8748453))的权利证书、专利查询证明、境外专利证明并经检索中国及多国专利审查信息查询网站(http://cpquery.cnipa.gov.cn/)、美国专利与商标局(http://www.uspto.gov/)等公开网站,江苏迈度系苏特替尼化合物的中国专利的唯一权利人、发行人系苏特替尼化合物的美国专利的唯一权利人,发行人及其子公司单独享有苏特替尼化合物专利的所有权,苏特替尼化合物专利的权属清晰。
2010年1月,江苏迈度与苏中药业签订了《技术开发(合作)合同书》,约定公司与苏中药业就苏特替尼进行合作研发。2020年8月,在2010年合作协议的基础上,公司与苏中药业对双方就苏特替尼项目合作进行中外双报,苏中药业负责苏特替尼在中国市场的临床、生产和注册申报的投资,江苏迈度负责苏特替尼在中国以外市场的临床、生产、注册申报的投资等事宜进行了明确约定,并进一步明确了双方在中、美市场销售分成的相关内容。此外,苏中药业分别于2022年1月、2022年2月出具相关说明,进一步确认合作研发的开展情况及苏特替尼化合物专利的权属划分。发行人与苏中药业对苏特替尼的权属划分明确、相关合作权利义务清晰;江苏迈度单独拥有苏特替尼化合物专利的所有权,苏中药业拥有苏特替尼化合物专利在中国的独占使用权。
自2010年至今,发行人牵头主导并持续深度参与到苏特替尼的研发活动,在临床前实验方案制定、适应症选择、临床试验方案制定、临床开发项目管理、临床试验数据分析、临床试验用药生产、临床试验研究者沟通、临床试验中心启动等关键环节发挥重要作用,并对研发过程中遇到的问题提供专业意见或技术指导,尤其是在适应症选择方面,发行人通过对国外非经典突变创新药研发态势的追踪分析,敏锐捕捉到苏特替尼在EGFR非经典突变的开发机会,双方由此确定苏特替尼的后续研发方向。针对苏特替尼IIb期临床试验,发行人牵头主导完成中美两地临床试验方案的设计,并就后续中国方面的临床方案执行及运营持续对苏中药业进行指导。双方合作良好,根据苏中药业出具的《关于苏特替尼进行合作研发的相关情况说明》,双方按照现有合同的约定推进各项工作,未发现任何一方有违约行为,未发生因履行合同产生争议和诉讼的情形,未发生基于现有合同向另一方及其关联方于任何时间以任何形式主张权利或追究任何责任或提出任何赔偿诉求的情形。
经检索互联网公开信息,截至本问询回复出具之日,公司与苏中药业之间不存在进行中或潜在的诉讼、仲裁或其他争议、纠纷,亦不存在涉及苏特替尼相关专利的权属及使用的任何争议、纠纷。
(来源:界面AI)
声明:本条内容由界面AI生成并授权使用,内容仅供参考,不构成投资建议。AI技术战略支持为有连云。
交易商排行
更多- 监管中EXNESS10-15年 | 英国监管 | 塞浦路斯监管 | 南非监管92.42
- 监管中FXTM 富拓10-15年 |塞浦路斯监管 | 英国监管 | 毛里求斯监管88.26
- 监管中axi15-20年 | 澳大利亚监管 | 英国监管 | 新西兰监管79.20
- 监管中GoldenGroup高地集团澳大利亚| 5-10年85.87
- 监管中Moneta Markets亿汇澳大利亚| 2-5年| 零售外汇牌照82.07
- 监管中GTCFX10-15年 | 阿联酋监管 | 毛里求斯监管 | 瓦努阿图监管60.90
- 监管中VSTAR塞浦路斯监管| 直通牌照(STP)80.00
- 监管中IC Markets10-15年 | 澳大利亚监管 | 塞浦路斯监管91.81
- 监管中金点国际集团 GD International Group澳大利亚| 1-2年86.64
- 监管中CPT Markets Limited5-10年 | 英国监管 | 伯利兹监管91.56